[schéma 1 - Manipulation I]
Objectif :
Déterminer la concentration en ions Fer (III) dans le vin blanc.
Introduction à l'expérience :
Le vin est un milieu très complexe contenant l'élément
fer sous forme d'ions Fer (II) Fe2+ et d'ions Fer (III) Fe3+. Une partie de
celui-ci est apportée par le raisin lui même, le reste est dû
à diverses sources de contamination pendant la vinification.
L'élément Fer intervient dans divers processus chimiques en catalysant
des réactions d'oxydation ou en entraînant des précipitations.
Par exemple, il peut y avoir une réaction entre les ions Fer (III) et
les ions phosphate PO43- contenus dans un vin :
Fe3+ + PO43- ==> FePO4 (s)
Il se forme alors un dépôt dans le vin :
ce phénomène est connu sous le nom de casse ferrique.
Il est donc important de doser l'élément Fer du vin pour éviter
la formation de ce dépôt.
Protocole expérimental :
Dans un premier temps, on met en évidence les ions Fer (III) dans le
vin blanc.
On désire ensuite doser la totalité de
l'élément fer contenu dans le vin. Afin que tout l'élément
Fer contenu dans le vin blanc soit sous forme d'ions Fer (III) libres, on doit
réaliser les deux opérations suivantes :
- On dissocie les ions complexes du Fer avec de l'acide chlorhydrique.
- On oxyde tous les ions Fer (II) en ions Fer (III) avec de l'eau oxygénée.
Puis, on forme, avec le thiocynate de potassium KSCN (en excès), l'ion
complexe rouge FeSCN2+. Le dosage est fait par comparaison avec une
échelle de teintes correspondant à des solutions titrées
d'ions fer (III) réalisées avec l'alun de fer et d'ammonium :
(NH4)2 SO4, Fe2(SO4)3,
24 H2O. D'où le nom de dosage colorimétrique donné
à cette méthode.
Nous avons réalisé cette expérience sous forme de quatre manipulations successives.
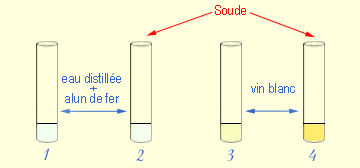
Manipulation I :
On teste les ions Fer (III) contenus dans le vin blanc avec de la soude (Schéma
1) :

[schéma 1 - Manipulation I]
|
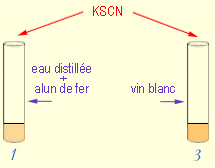
Manipulation II :
On prend les tubes 1 et 3, et on fait un test au thiocyanate de potassium KSCN
pour former, avec les ions Fe3+, un ion complexe de couleur rouge (Schéma
2) :
[schéma 2 - Manipulation II]
|
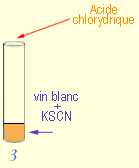
Manipulation III :
On met 1 mL d'acide chlorhydrique dans le tube 3, afin de modifier les ions
complexes de Fer en ions libres (Schéma 3) :
[schéma 3 - Manipulation III]
|
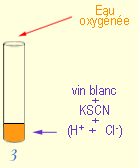
Manipulation IV :
On rajoute au tube précédent, le 3, quelques gouttes d'eau oxygénée
pour intensifier la coloration rouge (Schéma 4) :
[schéma 4. Manipulation IV]
|
Dosage :
Le dosage est réalisé sous forme colorimétrique : on réalise une échelle de teintes, puis on compare les concentrations des tubes à concentrations connues avec le tube dont on recherche la concentration.
On verse dans 10 tubes à essai différents une solution de 10 mL d'ions fer (III) à 2 mg.L-1 (tube 1), 4 mg.L-1 (tube 2), 6 mg.L-1 (tube 3), 8 mg.L-1 (tube 4), 10 mg.L-1 (tube 5), 12 mg.L-1 (tube 6), 14 mg.L-1 (tube 7), 16 mg.L-1 (tube 8), 18 mg.L-1 (tube 9), 20 mg.L-1 (tube 10). On ajoute ensuite 1 mL d’acide chlorhydrique, 1 mL de thiocyanure de potassium et 5 gouttes d’eau oxygénée. Dans un onzième tube, on met 10 mL de vin blanc et les mêmes réactifs.
|